La Alcalinidad es Vital para los Operadores de Plantas de Membrana de Nanofiltración y ósmosis Inversa
La palabra “alcalinidad” es probablemente una de las más utilizadas en nuestra industria. Los operadores de plantas de ósmosis inversa (RO) y nanofiltración (NF) tienen que medir la alcalinidad en la alimentación a su planta de membranas, así como en el permeado y en el agua terminada. Todos sabemos que la alta alcalinidad en el agua de alimentación puede causar incrustaciones en la membrana y que la baja alcalinidad en el agua final puede causar corrosión.
Pero, ¿Qué Significa Realmente la Alcalinidad?
Como el pH es una medida del ácido libre (protones de hidrógeno) en el agua, el pH del agua de alta pureza cae muy rápidamente con la adición de ácido. El agua subterránea, que contiene carbonatos y bicarbonatos que consumen ácido, requiere mayores cantidades de ácido para alcanzar el mismo pH objetivo. Esta resistencia al cambio de pH se conoce comúnmente como “capacidad de amortiguación”.
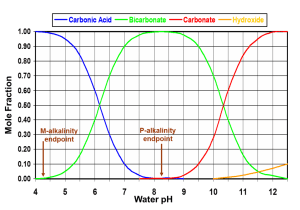
La alcalinidad se calcula por la cantidad de ácido necesaria para ajustar el pH a ~ 4.5 en el agua subterránea (y pH 4.2 en el agua de mar). Esto se debe a que los mayores contribuyentes a la alcalinidad son el carbonato y el bicarbonato, que se convierten completamente en ácido carbónico (CO2 disuelto) entre pH 4 y 5. En ese punto, ya no hay iones que consuman ácido de manera significativa.
La alcalinidad total se mide por titulación ácida de una solución a un pH de 4.5. Dado que un indicador de metil-naranja se usa típicamente para identificar el punto final, nos referimos a esta prueba como M-alcalinidad. Esta prueba tiene en cuenta todos los iones que proporcionan capacidad de amortiguación al agua. Además de carbonato y bicarbonato, los iones con capacidad de amortiguación incluyen fosfato y fosfato de hidrógeno (PO43- y HPO42-) a pH moderadamente alto, y silicatos e hidróxidos (y boratos en agua de mar) a pH muy alto.
La alcalinidad por encima de pH 8.3 se mide mediante la titulación ácida de una solución que contiene un indicador de fenolftaleína; por lo tanto, se conoce como alcalinidad P. Esto es principalmente una medida de la concentración de carbonatos que se convierten en bicarbonatos, hasta que los carbonatos son completamente consumidos por el ácido a pH 8.3. Sin embargo, el valor de P-Alcalinidad también se ve afectado por otros iones que reaccionan con el ácido a un pH más alto, incluidos los hidróxidos, silicatos, boratos y fosfatos.
Los valores medidos de alcalinidad M y alcalinidad P pueden usarse para calcular las concentraciones de carbonato y bicarbonato. Dado que la alcalinidad M representa tanto el carbonato como el bicarbonato, mientras que la alcalinidad P solo representa el ion carbonato, se puede usar la siguiente fórmula:
Alcalinidad de Bicarbonato (como CaCO3) = M-Alk – 2 * P-Alk
La alcalinidad P se multiplica por 2 por una razón muy simple: se necesitan dos protones ácidos para convertir cada ión carbonato en ácido carbónico, mientras que solo se necesita un protón ácido para convertir el ion bicarbonato en ácido carbónico.
CO3– + H+ = HCO3–
HCO3– + H+ = H2CO3
Dado que la alcalinidad M representa toda la alcalinidad, podemos calcular los carbonatos restando la alcalinidad del bicarbonato de la alcalinidad M.
Alcalinidad de Carbonatos (como CaCO3) = M-Alk – Alcalinidad de bicarbonatos (como CaCO3)
Aunque los iones hidróxido (OH–) contribuyen a la alcalinidad porque son consumidores de ácido, no tienen una capacidad de amortiguación significativa a pH <11. Cada ppm de ion OH– solo agrega 0.34 ppm de alcalinidad como CaCO3. Por el contrario, cada ppm de CO32 agrega 1.67 ppm de alcalinidad y cada ppm de HCO3 agrega 0.82 ppm de alcalinidad (como CaCO3).
La alcalinidad es muy importante en las aplicaciones de NF y RO porque puede aumentar el potencial de precipitación de las incrustaciones de carbonato. A un pH superior a 8.3 donde los carbonatos existen en concentraciones significativas, el potencial de incrustación de carbonato aumenta significativamente, al igual que la tasa de precipitación de incrustación de carbonato. Aunque la mayoría de los softwares de proyecciones de membranas y anti-incrustante solo calculan las saturaciones y los potenciales de precipitación para el carbonato de calcio, hay muchos otros tipos de incrustaciones de carbonato que se pueden formar. Estos incluyen carbonato de magnesio, carbonato de bario, carbonato de estroncio, carbonato ferroso y carbonato de manganeso. De hecho, en un sistema de RO típico que opera por debajo de pH 9, es más probable que el carbonato de manganeso sea un incrustante que el hidróxido de manganeso o el dióxido de manganeso, incluso cuando hay altos niveles de oxígeno disuelto (suponiendo que no haya oxidantes fuertes como cloro en el pretratamiento).
Obtenga más información sobre: Los Anti-incrustantes y Productos Químicos de Limpieza RO de American Water Chemicals